Privilégio Imunológico e Aspectos da Autoimunidade Ocular

Dr. Francisco Andrade
Disciplina de Uveítes e Doenças Autoimunes – CEPOA – Centro de Estudos e Pesquisas Oculistas Assosciados – Rio de Janeiro
Mestre em Doenças Autoimunes Sistêmicas – Universidade de Barcelona
Doutorando em Ciências Médicas – UERJ
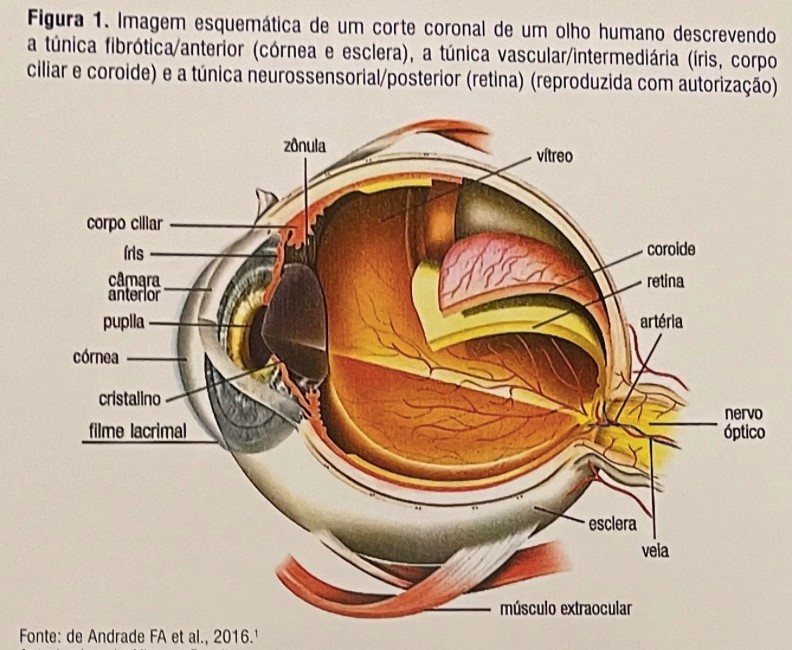
Anatomia do olho:
O olho é dividido anatomicamente em três camadas: uma camada externa ou fibrosa (córnea / esclera), uma camada média ou vascular (úvea - íris, corpo ciliar e coróide) e uma camada interna ou neurossensorial (retina) , como visto na figura 1. Eles compõem as diversas camadas anatômicas e funcionais que possibilitam a proteção imunológica do olho. A primeira camada envolve uma borda anatômica intacta com a barreira hemato-ocular e neuropeptídeos imunossupressores no humor aquoso nativo. A segunda camada confia na capacidade do olho de restabelecer um microambiente imunossupressor, ativando o TGF-β latente e restabelecendo o desvio imunológico associado à câmara anterior. A terceira camada envolve um mecanismo que ainda não é completamente reconhecido, mas que tem a capacidade de superar uma resposta imune intraocular predominantemente Th1 e de restabelecer o desvio imune associado à câmara anterior. A compreensão dos mecanismos abrangentes dessas vias levará ao desenvolvimento de novas estratégias de tratamento a fim de prevenir danos ao olho por inflamação persistente ou exacerbada, direcionada inicialmente a patógenos, mas que podem desenvolver uma reação autoimune. [1]
Privilégio imunológico e Aspectos da Autoimunidade Ocular:
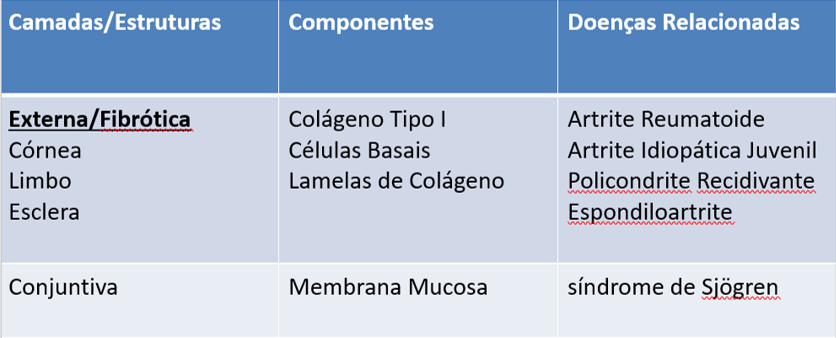
Devido à sua origem embrionária, sua anatomia peculiar e a presença de fatores fisiológicos que modulam a resposta imune, o olho apresenta características únicas em suas camadas, em sua histologia e que conferem o seu privilégio imunológico contra infecções e o sítio de manifestações de doenças autoimunes/inflamatórias. [2] (Tabela 1)

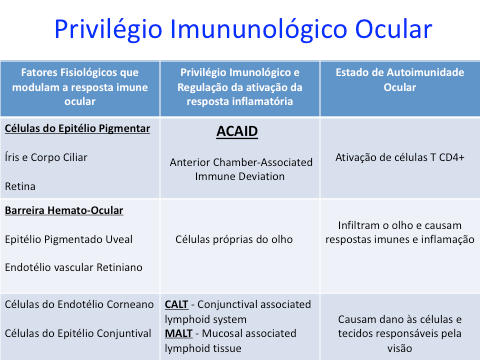
O controle das respostas imunes no olho é um exemplo de fenômeno geral que é a regulação da resposta inflamatória por condições locais e fatores que modulam a expressão da imunidade. Esses fatores variam desde a expressão de moléculas de adesão em quantidade ou qualidade específica para um órgão em particular até a produção local de substâncias imunomoduladoras. No olho, essas moléculas são sintetizadas localmente; elas regulam a expressão e indução de imunidade. Em condições de inflamação intraocular, as células T CD4 + ativadas se infiltram no olho e causam respostas imunológicas e inflamação, que danificam as células e tecidos relacionados à visão. No entanto, o olho tem um sistema imunológico único para proteger células e tecidos importantes das células T CD4 + efetoras ativadas. [3]
Quando Streilein e colegas descreveram o ACAID (Anterior chamber-associated immune deviation), eles forneceram a primeira evidência de que as células do parênquima ocular participam do chamado privilégio imunológico deste órgão [4,5]. Eles demonstraram que as células inoculadas na câmara anterior do olho induzem a supressão específica do antígeno da resposta imune celular, mas não da resposta imune humoral. A alteração imunológica surge quando os antígenos são colocados não apenas na câmara anterior, mas também na cavidade vítrea ou espaço sub-retiniano. O ACAID surge porque as células apresentadoras de antígenos intraoculares (APC) capturam o antígeno derivado do olho, migram diretamente para a corrente sanguínea através da rede trabecular e trafegam para o baço [6]. Mecanismos oculares do privilégio imunológico foram identificados e baseados em tecidos que contribuem para os sistemas de defesa deste órgão . Uma molécula importante que contribui para o privilégio imunológico no olho é o ligante Fas (FasL). Uma abundância de FasL é expressa constitutivamente por todo o olho. O FasL induz a apoptose de quaisquer células Fas + ativadas que entram no olho, e a morte celular induzida por FasL pode levar à tolerância e bloquear o crescimento adicional de vasos sanguíneos e que podem danificá-lo. O ligante indutor de apoptose relacionado ao TNF também é expresso nos tecidos oculares e participa na condição de um ambiente privilegiado na imunidade ocular. Além disso, a regulação imunológica fornecida por células oculares resistentes é um componente crítico do seu sistema de defesa [7].
Além disso, células próprias oculares (células epiteliais pigmentadas da íris, do corpo ciliar e da retina e as células endoteliais da córnea) contribuem para o seu privilégio imunológico por outro sistema de regulação imune, que não é específica para o antígeno derivado do olho. As células próprias oculares são capazes de suprimir diretamente as células T ativadas por anticorpos anti-CD3, mas não por antígenos derivados do olho [8-11]. Desde então, esse conceito evoluiu e outros mecanismos de regulação imunológica demonstraram desempenhar um papel crítico nas doenças oculares.
Quando os mecanismos de proteção falham e as condições genéticas e ambientais geralmente estão presentes, ocorre o desenvolvimento do estado de autoimunidade ocular. Na uveíte autoimune experimental, a quebra da tolerância é facilmente perceptível devido à indução da doença alcançada pela imunização ativa do modelo com um autoantígeno, como a molécula de ligação retinóide ou antígeno S retiniano (S-Ag) [12].
No caso específico do olho, a quebra da barreira hemato-retiniana costuma ser o início do processo autoimune nas células fotrreceptoras e sendo reconhecida como um fator precipitante nesse processo. Os eventos que levaram à quebra da barreira hemato-retiniana foram extensivamente estudados em uveíte autoimune experimental e os resultados obtidos forneceram pistas sobre o que pode ocorrer com pacientes humanos [13].
Em relação ao mecanismo de autoimunidade retiniana, é claro que deve haver uma maneira pela qual os autoantígenos retinianos possam ser apresentados localmente às células T ativadas perifericamente. Para que as células presentes na retina funcionem potencialmente como APC, elas devem possuir os marcadores necessários para realizar a função de apresentação. O mais importante deles é a capacidade de expressar as moléculas MHC de classe II. As células retinianas que se enquadram nesta categoria incluem células endoteliais, células epiteliais pigmentadas da retina, células de Müller e células microgliais [14]. (Tabela 2)
Conclusão:
Uma vez que a visão pode ser potencialmente prejudicada por qualquer inflamação intraocular, incluindo lesão inflamatória imunomediada, parece que o olho se adaptou evolutivamente para se beneficiar da proteção contra patógenos ao mesmo tempo em que evita a cegueira por lesão imunológica. Assim, muitos acreditam que o olho é um local privilegiado em termos de imunidade. Este privilégio depende da integridade das estruturas anatômicas e bioquímicas do olho, como a falta de drenagem linfática e a presença de barreira hemato-ocular que protege os antígenos oculares do sistema imunológico [15].
A compreensão dos mecanismos detalhados dessas vias, invariavelmente, levará ao desenvolvimento de novas estratégias de tratamento a fim de prevenir danos ao olho por uma reação inflamatória persistente ou exagerada, ou seja, pelo menos inicialmente, uma resposta protetora contra patógenos que ameaça a sua integridade e uma outra que pode desencadear reações autoimunes.
Referências:
[1] Forrester JV, Xu H. Good news–bad news: the Yin and Yang of immune privilege in the eye. Front Immunol 2012;3:338.
[2] Kaines A, Tsui I, Sarraf D, Schwartz S. The use of ultra wide field fluorescein angiog-
raphy in evaluation and management of uveitis. Semin Ophthalmol 2009;24(1):
19–24.
[3] Streilein JW. Ocular immune privilege and the Faustian dilemma. The Proctor lec-
ture.
Invest Ophthalmol Vis Sci 1996;37(10):1940–50.
[4] Streilein JW. Ocular immune privilege: the eye takes a dim
but practical view of im-
munity and
inflammation. J Leukoc Biol 2003;74(2):179–85.
[5] Caspi RR. Ocular autoimmunity: the price of privilege?
Immunol Rev 2006;213:
23–35.
[6] Mochizuki M, Sugita S, Kamoi K. Immunological homeostasis of the eye. Prog Retin
Eye Res 2013;33:10–27.
[7] Taylor AW. Ocular immune privilege. Eye (Lond) 2009;23(10):1885–9.
[8] Taylor AW, Kaplan HJ. Ocular immune privilege in the year 2010: ocular immune
privilege
and uveitis. Ocul Immunol Inflamm 2010;18(6):488–92.
[9] Sugita S, Usui Y, Horie S, Futagami Y, Aburatani H, Okazaki
T, et al. T-cell suppres- sion by programmed cell death 1 ligand 1 on retinal
pigment epithelium during in-
flammatory
conditions. Invest Ophthalmol Vis Sci 2009;50(6):2862–70.
[10] Sugita S, Horie S, Nakamura O, Futagami Y, Takase H, Keino
H, et al. Retinal pigment epithelium-derived CTLA-2 alpha induces TGF
beta-producing T regulatory cells.
J Immunol
2008;181(11):7525–36.
[11] Horie S, Sugita S, Futagami Y, Kawaguchi T, Kamoi K, Shirato
S, et al. Human iris
pigment epithelium suppresses activation of bystander T cells via TGFbeta–
TGFbeta receptor interaction. Exp Eye Res 2009;88(6):1033–42.
[12] DeVossJ,HouY,JohannesK,LuW,LiouGI,RinnJ,etal.Spontaneousautoimmunity prevented by thymic expression of a single self-antigen. J Exp Med 2006;203(12): 2727–35.
[13] Greenwood J, Howes R, Lightman S. The blood–retinal barrier in experimental au- toimmune uveoretinitis. Leukocyte interactions and functional damage. Lab Invest 1994;70(1):39–52.
[14] Horai R, Silver PB, Chen J, Agarwal RK, Chong WP, Jittayasothorn Y, et al. Break- down of immune privilege and spontaneous autoimmunity in mice expressing a transgenic T cell receptor specific for a retinal autoantigen. J Autoimmun 2013; 44:21–33.
[15] Streilein JW, Ohta K, Mo JS, Taylor AW. Ocular immune privilege and the impact of intraocular inflammation. DNA Cell Biol 2002;21(5-6):453–9.
